イントロダクション
皆さんは、薬の情報を調べるときに、どの媒体から入手されているでしょうか?
大多数の方は、添付文書、インタビューフォーム等でしょうか?
RMPは、添付文書には記載されていないような、『関連がありそうな隠れたリスク』についても、記載されていたり、新しい薬を扱う時や、初めて薬剤を投与する前に確認することで、有効に使用できます。
また、患者教育や医療者向けの資材の提供情報もあり、日常診療にはなくてはならない便利ツールです。
この記事では、『RMPとは?』『閲覧方法』『活用事例』『国家試験』について説明しています。
目次より、みたい内容に飛んでいただければと思います。
以下のような経験がある医師・看護師・薬剤師などの職種の方は、ぜひ『RMP』を使用することをおすすめします!
そんな時に手助けとなってくれるのが、RMPです!
以下のリンクから、検索できます!
医薬品リスク管理計画(RMP:Risk Management Plan) | 独立行政法人 医薬品医療機器総合機構 (pmda.go.jp)
使い方を知って、便利に活用していきましょう!
医薬品リスク管理計画【RMP】とは?
医薬品の『安全性』を確保するために、医薬品の開発段階から市販後を通じて、不足情報をどのように収集するか、既知のリスクをどのように低減するかをまとめた文章です。
RMPは下の3つの柱で、構成されております。
- 安全性検討事項
- 医薬品安全性監視計画
- リスク最小化計画

詳細は、後半で説明したいと思いますが、上記の図のような関係性で、メインの『安全性検討事項』を作成・実行するために、どのような情報を収集するのかを『医薬品安全性監視計画』で決めて活動し、どのように医療者、患者に情報提供するのか『リスク最小計画』で決めて、活動しています。
その他、RMPの関連資料で、適正使用ガイドや患者向け資材などが作成されています。
添付文書とRMPの違いは?
医療関係者の方であれば、医薬品の情報と言えば、まず『添付文書』が思いつくと思います。
添付文書は、薬機法に基づいた公的文書であり、警告や禁忌、適応疾患、用法用量、重大な副作用やそのほかの副作用などが記載されています。
基本的に、新薬の添付文書は、治験時での情報となりますが、治験では、Five toosがあり、問題となります。
- too few (試験患者が少ない)
- too simple (合併症や併用薬が限られている)
- too narrow (適応疾患が限定されている、除外基準など)
- too median-age (高齢者・小児など年齢によって除外される)
- too brief (投与期間・試験期間が短い)
上記のように、治験での症例は限られた集団・症例数における結果なので、実際に薬として販売され、多くの人が内服した場合に、どんな影響ができるかは不確かではありません。また高齢者や小児における情報は特に不足しています。
このように、治験時に薬との因果関係がはっきりとしているリスクもあれば、もしかしたら、治験では、明らかにはならなかたったけど、関連が疑わしく十分な確証がないリスクもあります。
この『関連はありそうだけど、確認が十分でない可能性』については、約半数が添付文書に載っていないです。
RMPは、開発から市販後までの一貫した情報がまとまっていて、こうした『関連はありそうだけど、確認が十分でない可能性』を『重篤な潜在的なリスク』として記載さています。
上手に使用していくことで、いままで関連性の見えてこなかった有害事象の可能性なども見えてきそうですね。
RMPでは、添付文書と異なり、3つのリスクについて記載されています。
以下の3つをまとめて、『安全性検討事項』と呼ばれています。
治験時や市販後に確認されている副作用のうち『重要な特定されたリスク』
既に確認がされたリスクだけではなく、関連が疑わしいが確認が十分でない『重要な潜在的リスク』
高齢者や小児など情報が不足している条件での『重要な不足情報』
閲覧方法
PMDAへアクセス
医薬品の情報検索は、PMDA(Pharmaceuticals and Medical Devices Agenc)の検索で行うように心がけましょう。
PMDAは厚生労働省管轄の独立行政法人です。添付文書についても、頻繁に改定されますので、インターネットで検索する場合、改定前の情報が掲載されている場合があります。
PMDAのホームページから、閲覧することで、不適切な医薬品情報の収集を防ぐことができます。

検索方法
RMP提出品目一覧から探す
実は、RMPが策定されている医薬品はすべてではありません。上記画面の青枠『RMP 提出品目一覧』から、五十音順で表示されます。
RMPが記載されている医薬品がすべて掲載されいますので、時間のあるときに、目を通してみると新しい発見があると思います。新人の薬剤師の勉強にも役に立ちます!
平成24年4月に、『医薬品リスク管理計画指針』および『医薬品リスク管理計画の策定について』がとりまとめられたために、適応される医薬品に制限があります。
- 新医薬の申請時
- バイオ後続品の承認申請時
- 先発医薬品で『安全性監視活動』または『リスク最小化活動』を追加で実施された後発医薬品の申請時
- 医薬品の製造販売後に新たな安全性の懸念の発生時
医療用医薬品情報検索から探す
こちらは、画面の赤枠の方です。医薬品名での検索ができるので、ピンポイントで情報を得られます。
業務で使用する場合は、こちらを利用しているかたが多いと思います。
もちろん、RMPがない医薬品もありますが、今回は、『医療用医薬品情報検索』から検索方法を見ていきましょう。
検索の際は、下の画像の赤枠に医薬品名を入力します。青枠のチェック項目で、検索情報のソートでできるので、必要に応じてチェックしていきましょう。今回は、PMPにチェックが入っていることを確認しておきましょう。
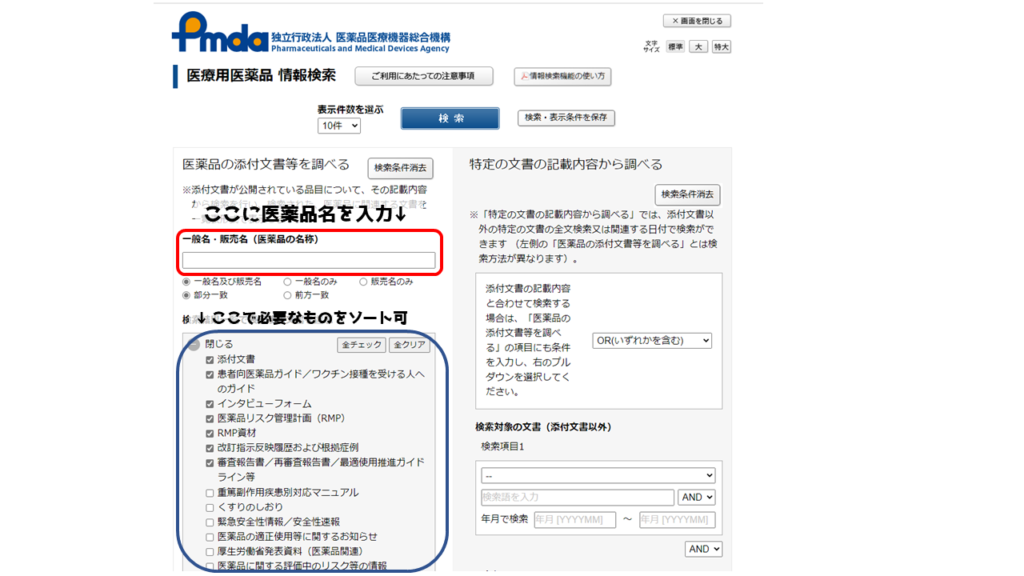
例.医薬品を検索してみよう
今回は、ニンテタニブ『商品名:オフェブ』を例に検索していきましょう。
医療用医薬品情報検索から、医薬品名を入力し、検索していきます。ひらがなでも検索できます。
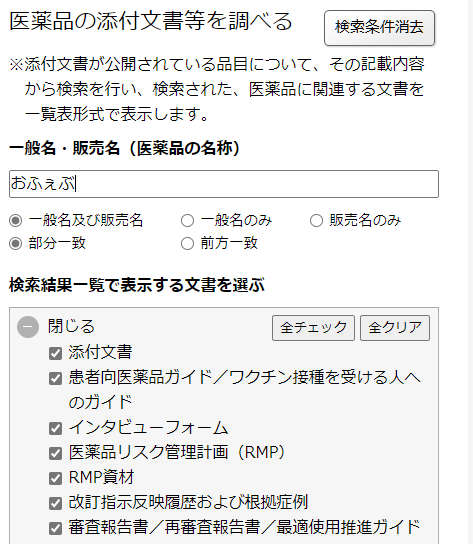
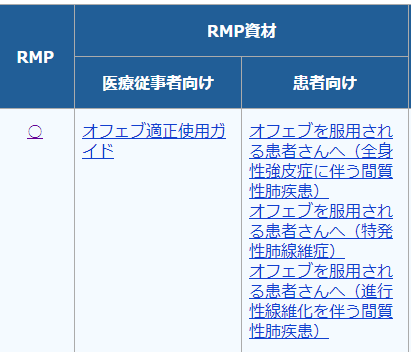
検索すると、以下の検索結果が出てきます。赤枠で囲ったRMPの欄に「○」があれば、RMPが作成されている医薬品となります。「○」をクリックするとRMPのページへ飛びます。
また、RMP資材として、適正使用ガイドや患者向け資料も掲載されています。

医薬品リスク管理計画表の見方
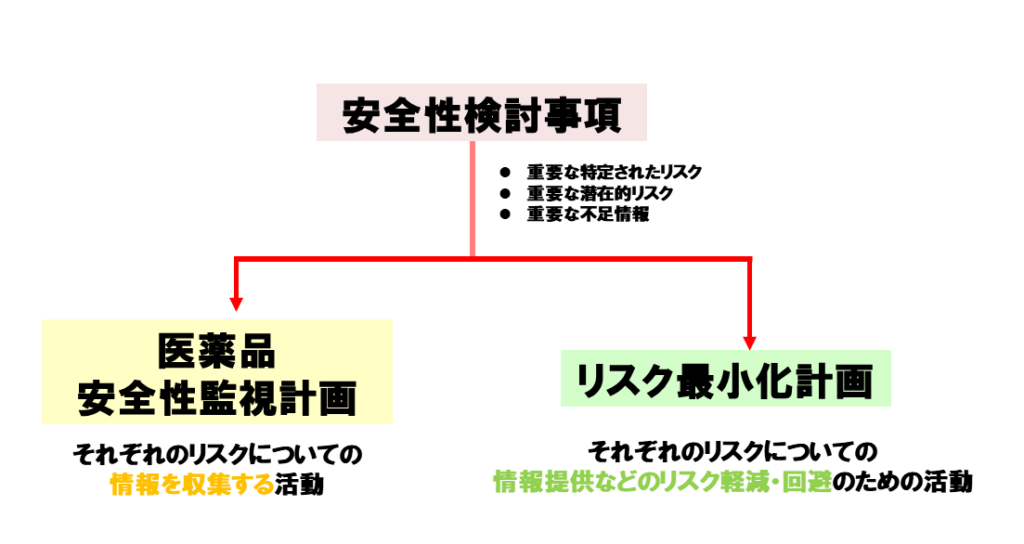
まずは、医薬品リスク管理計画表(RPM)の項目をおさらいしていきます。上の画像の3本柱で構成されています。
安全性検討事項
実際の安全性検討事項は、下の画像のように表示されています。
すでにわかっているリスクだけではなく、潜在的なリスクや不足している情報を補完できます。
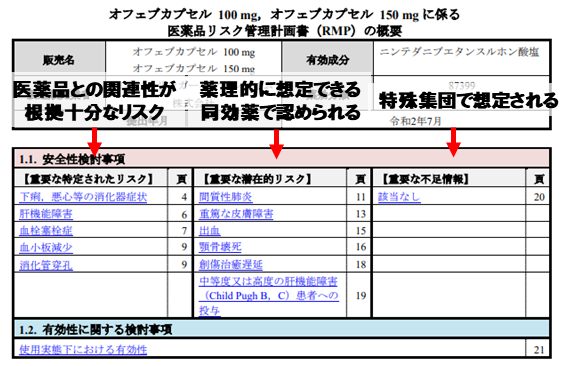
その医薬品の有効性・安全栓のバランスの影響を及ぼす可能性のある重要な3つの事項が掲載されています。
- 重要な特定されたリスク : 治験時や市販後に関連が確認されている副作用
- 重要な潜在的リスク:関連は疑わしいけど、確認が十分でない有害事象
- 重要な不足情報:高齢者・小児など薬物動態の異なる集団での情報
添付文書とRMPを比較していきましょう。
まず、添付文書の副作用の項目を確認していきましょう。
重大な副作用に「重度の下痢」がありますが、その他の副作用として、下痢、悪心、嘔吐もあります。

RMPを見ていきましょう。
重要な特定されたリスクをみると、「下痢、悪心等の消化器症状」の記載がありました。
リンクがあるので、詳細ページに飛べます。


重要な特定されたリスクを確認すると、「下痢、悪心等の消化器症状」の副作用の機序・頻度・添付文書に至った経緯が詳細に掲載されています。
添付文書で「その他の副作用」と記載されていても、RMPでは、重要な特定されたリスクに記載があれば、十分に根拠のある副作用であるので、副作用モニタリングをきちんと行っていく必要があります。
また、それぞれの安全性検討事項に対して、「医薬品安全性監視活動」の内容とその選択理由、「リスク最小化活動」の内容とその選択理由についても記載してありますね。
例えば、今回は、下痢、悪心等の消化器症状の可能性がある場合にどうすればよいか知りたいと思ったときに、リスク最小化活動に、医療関係者向けの資材、患者向けの資材を作成することが記載されていますので、それを参考をすることができます。

医薬品安全性監視計画
主に情報収集に関する活動です。
医薬品安全性監視活動は大きく分けて「通常の活動」と「追加の活動」の2つあります。
通常の活動は、すべての医薬品が対象となりますが、追加の活動は必要に応じて、追加されます。
通常の活動としては、「副作用症例の収集」
追加の活動としては、「市販直後調査、使用成績調査、市販後臨床試験など」
リスク最小化計画
主に情報提供に関する活動です。
リスク最小化計画の活動は大きく分けて「通常の活動」と「追加の活動」の2つあります。
通常の活動としては、「添付文書・患者向け医薬品ガイドの作成及び提供」
追加の活動としては、「市販直後調査における情報提供、適正使用ガイド、患者向けの資材など」
適正使用ガイド
適正使用ガイドは、投与患者の選択、投与方法、投与開始時や投与中に注意すべき事項、副作用やQ&Aなどの記載があります。
以下、オフェブの適正使用ガイドの表紙ですが、RMPの追加の活動の一環として作成された資料は、青い「医薬品リスク管理計画(RMP)」や、オレンジの「市販直後調査」などのマークが掲載されることとなっています。
このマークがついていると、承認審査時にPMDAが必要性や内容を確認しているものになるので、内容が担保されているものとして、判断の材料になります。

今回は、「下痢、悪心等の消化器症状」の対策について、知りたかったのですが、以下の情報がありました。
医薬品によって、副作用に対する支持療法などについて記載のあるものあるので、現場において非常に役に立ち、なくてはならいものだと感じています。


患者向けの資材
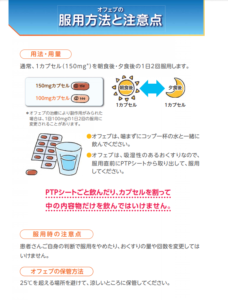
患者やその家族が理解できるような資料です。
医療用語は難しいですが、噛み砕いた内容で記載されていますので、薬剤の説明時に役に立ちます。
作用機序、服用方法や保存方法の注意点、副作用、緊急時の対応など、抜けなく説明することができます。

活用事例
新しい薬を扱う時
新薬を病院で採用する際には、製薬メーカーによる説明会が開催され、『有効性』や『安全性』などか妥当かどうかを検討しています。
細かい情報は、『審査報告書』に載っていますが、RMPはリスクについて、わかりやすく載っているため、説明会前に取り寄せておくことで、より注意点を把握しておくことができます。
副作用が起こりうる推定されている発症機序や臨床試験の成績を確認できます。推定されている発生機序を見ることによって、どのくらいの投与期間で影響がでそうか、また人種差や遺伝子多型による影響がでそうかどうかの理解を深められます。
また、適正使用のためのリーフレットなどの配布が予定されているか確認できます。
製薬企業のMRさんやPMDAのホームページから、資材を入手し、内容や使いやすさについて把握しておくことができます。
服薬指導を行うにあたって
リーフレットや資材を服薬指導時に使用されていると思いますが、RMPマークがついている資材は、重要性が変わってきます。
RMPは医薬品の承認の条件となっています。そこで、さらなる情報提供が安全性に不可欠と判断された場合に、作成された資材である証として、RMPマークが与えられるます。
つまり、RMPマークがついている資材を用いて、服薬指導を行うことで、隠れた副作用の可能性に対しても、アプローチができることになります。
資材によっては、初回説明に特化したものや、薬袋に入るサイズの継続して意識して欲しい情報などいろいろありあす。どんな支持が、提供されているかを確認して、状況によって使い分けることによって、質の向上や時間の節約にも繋がります。
副作用が疑われた時
国家試験を見てみよう
第104回にRMPについての国家試験問題があったので、どんなことが求められているか見てみましょう。


と、言うわけで、正解は1,5だと思いました!
合っていたので、一安心です。
そもそも、RMPは「医薬品のリスクを最小化する」ためのものなので、国家試験でも、特定されたリスク、潜在的なリスクなどから、早期の副作用の発見につなげて欲しいというメッセージが見え隠れしていますね。









